Científicos de California crean una bacteria con tres pares de bases de ADN en lugar de los dos naturales
El avance multiplica las aplicaciones de la biología sintética y plantea el debate de las patentes de seres vivos
- GRÁFICO Dos nuevas ‘letras’ en el alfabeto genético http://elpais.com/elpais/2014/05/07/media/1399487245_108039.html
La creación de vida artificial se acerca así un paso más, después de la creación de los genomas completos de una bacteria y de un cromosoma de la levadura, en ambos casos a partir de productos químicos de bote. Pero el nuevo avance plantea cuestiones inéditas, y no solo para los ingenieros. Por ejemplo, como el alfabeto ampliado permite construir genes y proteínas con componentes nunca vistos en la naturaleza, ¿se pueden patentar seres vivos con estas letras artificiales?
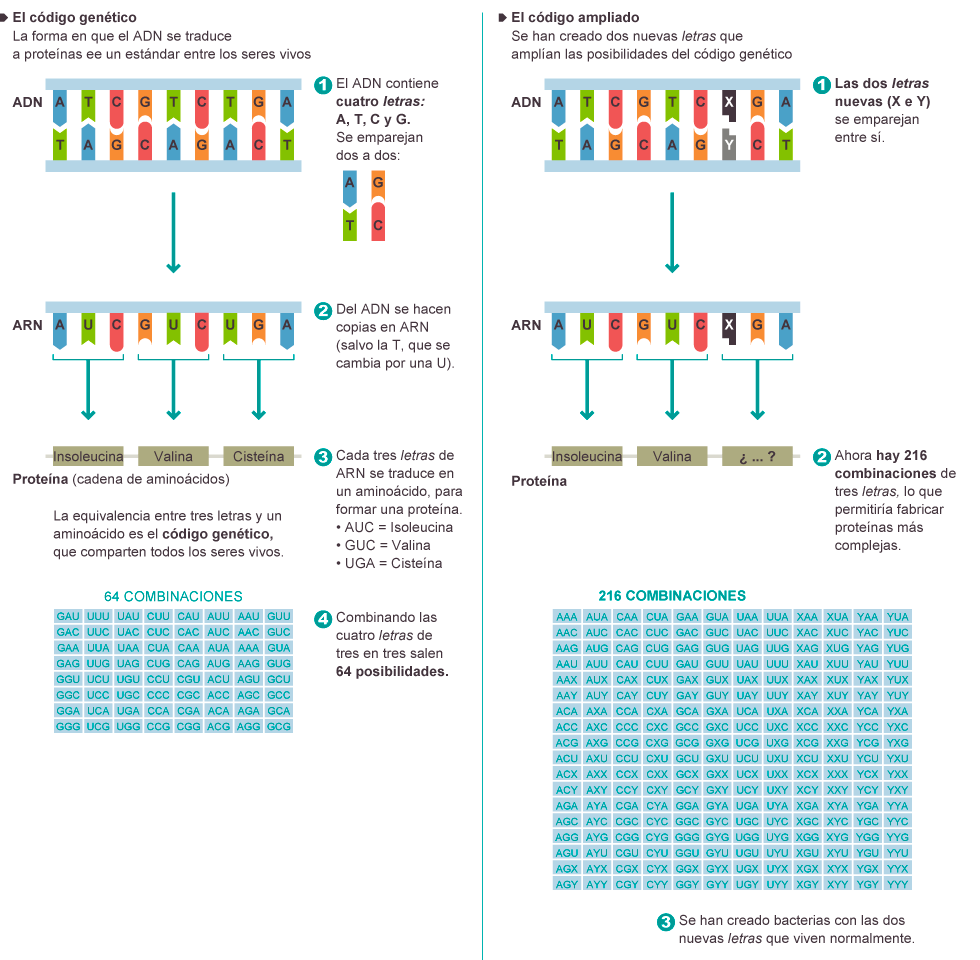
- A estas alturas del siglo XXI sigue sin estar claro que haya leyes universales de la biología, pero si alguna puede aspirar a ese título es la naturaleza de la información genética. Desde la más humilde bacteria hasta el lector de este artículo, todos los seres vivos del planeta Tierra utilizan para ese propósito la doble hélice del ADN y un código genético de cuatro ‘letras’ (a, g, t, c), las cuatro bases o nucleótidos con que se escribe todo texto biológico, o “el lenguaje de Dios”, en la peculiar nomenclatura del presidente Clinton.
- Ese lenguaje de cuatro letras ha resultado muy servicial a los seres vivos desde hace al menos 3.500 millones de años. Pero la razón, sabemos ahora, no es que sea el único posible, porque la bacteria creada por Romesberg y sus colegas parece funcionar igual de bien con seis letras que con las cuatro naturales. Animados por este hecho, los científicos ya están pensando en añadir aún más bases artificiales al código genético de sus criaturas. Aunque no es eso, desde luego, lo que más prisa les corre.
El trabajo de Romesberg, que se presenta en Nature, es una prueba de principio, pero tanto él como otros expertos en la emergente disciplina de la biología sintética –el diseño de organismos a partir de principios básicos— lo consideran un gran paso adelante. Creen que facilitará mucho los objetivos a corto plazo de esta tecnología, que son la síntesis de medicamentos, la producción de biocombustibles, la alimentación y la regeneración de los entornos dañados por toda clase de vertidos.
La biología sintética pretende crear desde cero sistemas biológicos –como circuitos genéticos, bacterias y células superiores— que no existen en la naturaleza, y que están diseñados para algún propósito práctico concreto. Pese a ser un campo de investigación con apenas 10 años de historia, ya se ha apuntado algunos logros: bacterias que funcionan como biosensores; otras que sintetizan artemisina (un fármaco contra la malaria), y una serie de fagos (virus bacteriófagos, o que infectan a las bacterias) diseñados para disolver los biofilms que forman los microorganismos.
Entre las perspectivas más inmediatas, los biólogos biosintéticos se plantean facilitar la producción de más fármacos –cuyas rutas sintéticas son a veces de una complejidad mareante, y de un precio disuasorio—, y también etanol y otros productos útiles como combustibles. “La capacidad de construir organismos fotosintéticos puede llegar incluso a permitirnos utilizar la luz solar como la fuente de energía última, y el dióxido de carbono (CO2) como la única fuente de carbono”, dice el bioquímico Andy Ellington, de la Universidad de Texas en Austin.
Entender el avance de Romesberg y su equipo de La Jolla requiere un somero repaso de los elementos de la biología molecular. La doble hélice del ADN consiste en dos muelles imbricados entre sí (‘hélice’ no es más que el nombre matemático de un muelle). A lo largo de cada muelle discurre la secuencia de bases (ctaacgttaa…), el ‘texto’ que contiene la información genética. Y lo que mantiene unidos los dos muelles es la afinidad selectiva: ‘a’ se aparea con ‘t’, ‘c’ se aparea con ‘g’. Este apareamiento específico es la clave de la replicación: al separar los dos muelles, cada uno puede reconstruir al otro.
Las nuevas bases artificiales también se aparean una con otra (d5SICSTP con dNaMPT), y gracias a ello pueden replicarse como sus colegas naturales. Un logro esencial de los biólogos de California ha sido garantizar que la bacteria pueda conseguir del entorno las nuevas bases en su forma simple, para luego incorporarlas a su ADN. Ello ha requerido situar en su membrana un transportador con las suficientes tragaderas, que han tomado de un alga.
Dentro de cada muelle, la información se organiza en grupos de tres letras (tripletes, o codones, como agt o ccc). Cada codón de un gen significa un aminoácido de una proteína (las proteínas son rosarios de 20 tipos de aminoácidos). Con las cuatro bases naturales, se pueden formar 64 (4 elevado a 3) codones distintos. Con las seis bases que resultan al añadir las dos artificiales, se pueden formar 216 (6 elevado a 3) codones distintos. El nuevo par de letras, por tanto, triplica con creces la capacidad de código del ADN.
“Es posible que la maquinaria biológica que han usado Romesberg y sus colegas permita a la bacteria, con el tiempo, adoptar las dos bases artificiales como parte de su propio alfabeto genético”, escriben en Nature Ross Thyer y Jared Ellefson, del Centro de Biología Sintética y de Sistemas de la Universidad de Texas en Austin. “De ser así se abriría un nuevo panorama en el que la ingeniería humana podría saltar sobre un abismo que previamente había sido insondable para la evolución”. Habría que preguntarse entonces por qué la vida se paró en cuatro letras y ha seguido así durante 3.500 millones de años.
Thyer y Ellefson tienen claro cuál será el siguiente paso. El ADN no se traduce a proteínas directamente: hay un paso intermedio, lla mado transcripción, que saca una copia de trabajo de uno de los muelles de la doble hélice y produce una molécula muy similar al ADN, pero con solo una hilera de bases: el ARN, que es quien accede a las maquinarias celulares que traducen la secuencia de bases (ggtacctt…) a la secuencia de aminoácidos que forma las proteínas. Los científicos de California no han mostrado aún que las dos nuevas bases se puedan transcribir como ARN, y eso es lo próximo que tienen que comprobar.
De hecho, el ARN no es solo un intermediario para fabricar proteínas: también es capaz de plegarse en sofisticadas estructuras tridimensionales que tienen funciones propias. Por ejemplo, pueden reconocer pequeñas moléculas del entorno celular y activar o desactivar genes en consecuencia (los llamados riboswitches). También se asocian a las proteínas formando complejos esenciales para la vida (lasribonucleoproteínas).
La incorporación de las dos bases artificiales a estas estructuras abriría un nuevo campo para los bioingenieros. Y ello mucho antes de empezar a hablar de nuevas proteínas con inéditos aminoácidos que resulten útiles, e incluso patentables. Pero a la larga habrá que considerar esa posibilidad también. “Un alfabeto genético expandido conducirá a un alfabeto de proteínas expandido”, predicen Thyer y Ellefson. Es un tiro largo, pero no muy arriesgado.
El Tribunal Supremo de EE UU sentenció en 2013 que “los productos de la naturaleza” no se pueden patentar
En junio del año pasado, el Tribunal Supremo de Estados Unidos sentó un precedente muy importante al dictaminar, en un caso contra la comercialización de un test para el cáncer de mama por la firma Myriad Genetics, que “los productos de la naturaleza” no se pueden patentar. Los jueces se referían a la secuencia de los genes que confieren susceptibilidad al cáncer, que en efecto son productos de la naturaleza, si bien no de los más brillantes.
Pero el nuevo ADN con seis letras es cualquier cosa menos un producto de la naturaleza, y tal y como está hoy la jurisprudencia, al menos en Estados Unidos, será tan patentable como la fórmula de la viagra, aunque seguramente no tan rentable.
No hay comentarios:
Publicar un comentario